Indicadores del cambio climático: acidez oceánica
Estos indicadores describen los cambios en la química del océano que se relacionan con la cantidad de dióxido de carbono disuelto en el agua

Puntos clave
- Las mediciones realizadas en las últimas décadas han demostrado que los niveles de dióxido de carbono en los océanos han aumentado en respuesta al aumento del dióxido de carbono en la atmósfera, lo que lleva a un aumento de la acidez (es decir, una disminución del pH) (ver Figura 1).
- El modelo histórico sugiere que desde la década de 1880, el aumento del dióxido de carbono ha llevado a niveles más bajos de saturación de aragonito en los océanos de todo el mundo, lo que dificulta que ciertos organismos construyan y mantengan sus esqueletos y conchas (consulte la Figura 2).
- Las mayores disminuciones en la saturación de aragonito se han producido en aguas tropicales (ver Figura 2); sin embargo, las disminuciones en las áreas frías pueden ser más preocupantes porque las aguas más frías generalmente tienen niveles más bajos de saturación de aragonito para comenzar.
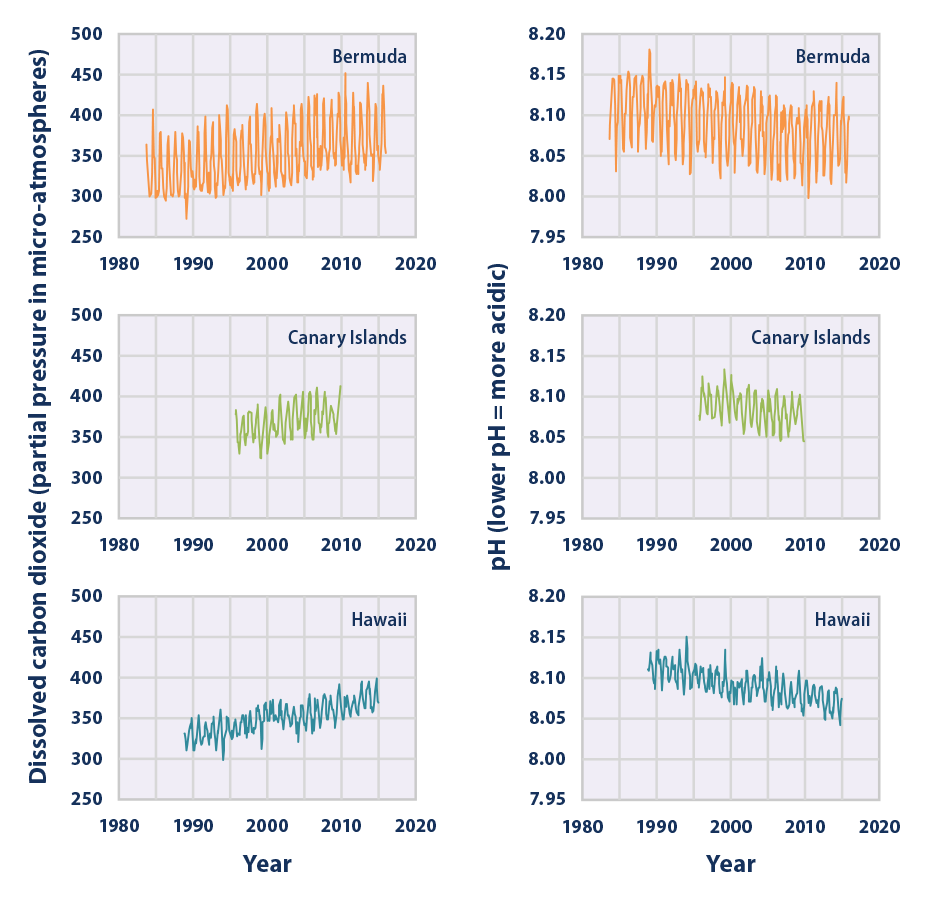
Esta figura muestra la relación entre los cambios en los niveles de dióxido de carbono del océano (medidos en la columna izquierda como una presión parcial, una forma común de medir la cantidad de un gas) y la acidez (medida como pH en la columna derecha). Los datos provienen de dos estaciones de observación en el Océano Atlántico Norte (Islas Canarias y Bermudas) y una en el Pacífico (Hawai). El patrón de altibajos muestra la influencia de las variaciones estacionales.
Fuentes de datos: Bates, 2016; González-Dávila, 2012; Dore, 20157
Actualización web: agosto 2016
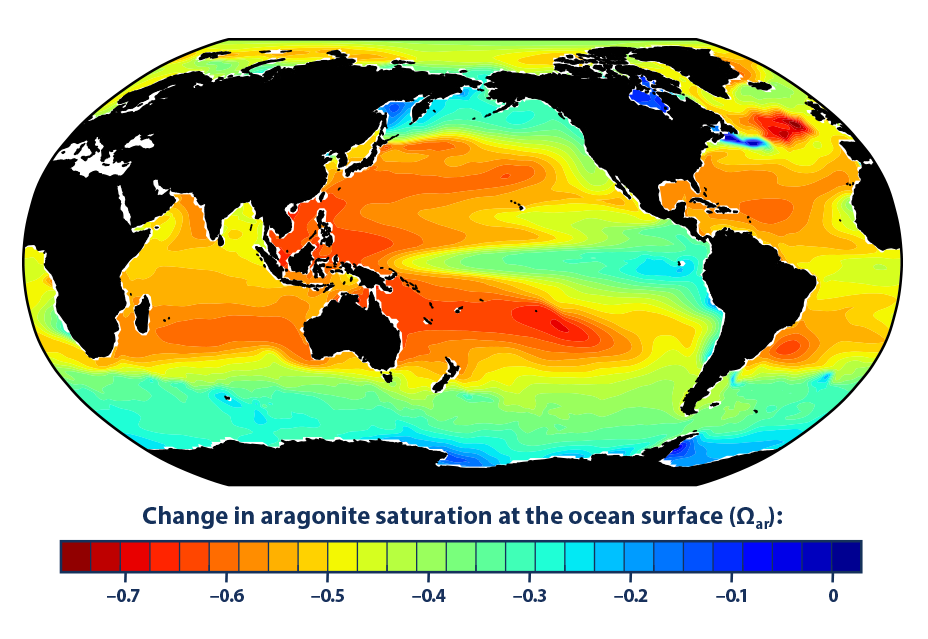
Este mapa muestra los cambios en el nivel de saturación de aragonito de las aguas superficiales del océano entre la década de 1880 y la década más reciente (2006-2015). El aragonito es una forma de carbonato de calcio que muchos animales marinos utilizan para construir sus esqueletos y conchas. Cuanto más bajo sea el nivel de saturación, más difícil será para los organismos construir y mantener sus esqueletos y conchas. Un cambio negativo representa una disminución en la saturación.
Fuente de datos: Institución Oceanográfica Woods Hole, 2016
Actualización web: agosto 2016
Escala de pH
La acidez se mide comúnmente utilizando la escala de pH. El agua pura tiene un pH de aproximadamente 7, que se considera neutral. Una sustancia con un pH inferior a 7 se considera ácida, mientras que una sustancia con un pH superior a 7 se considera básica o alcalina. Cuanto más bajo sea el pH, más ácida es la sustancia.
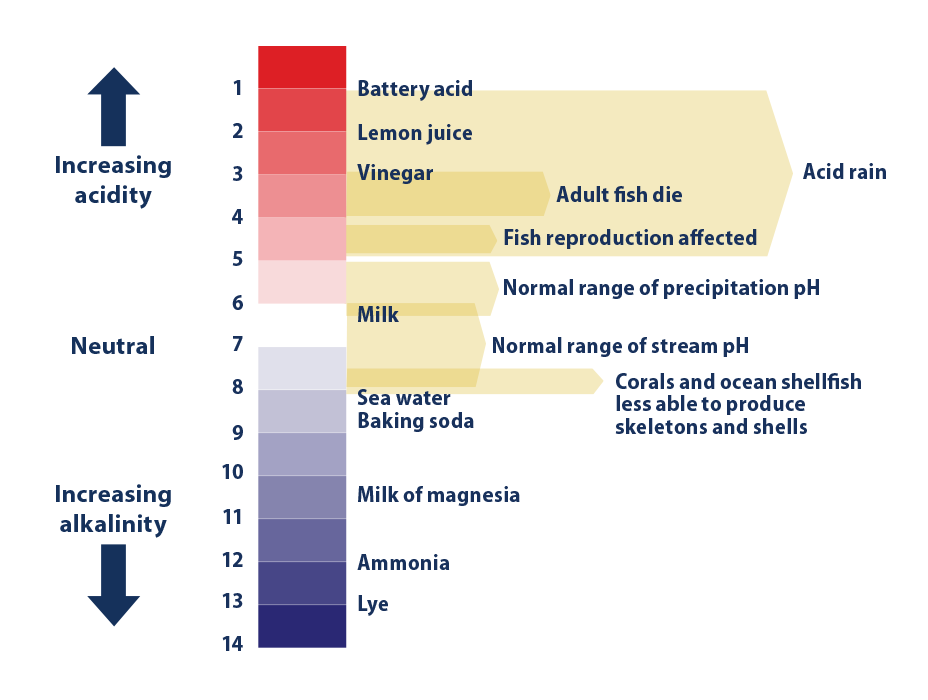
Al igual que la conocida escala de Richter para medir terremotos, la escala de pH se basa en potencias de 10, lo que significa que una sustancia con un pH de 3 es 10 veces más ácida que una sustancia con un pH de 4. Para obtener más información sobre el pH, Visite: http://www.epa.gov/acidrain/what-acid-rain
Fuentes: Environment Canada, 2008, con datos adicionales del IPCC, 201410
Actualización web: agosto 2016
EPA
No te pierdas la última hora de Meteored y disfruta de todos nuestros contenidos en Google Discover totalmente GRATIS
+ Seguir a Meteored