Los científicos tratan de acabar con el jet lag y descubren el secreto para regular nuestro reloj biológico
Los científicos descubren un nuevo enfoque para ajustar nuestros ritmos circadianos, los ciclos naturales de 24 horas que influyen en los patrones de sueño y vigilia y en las funciones diarias generales.

Los científicos han descubierto una forma revolucionaria de acabar con el jet lag al descubrir el secreto que se esconde tras la proteína caseína quinasa 1 delta (CK1δ), que regula nuestro reloj biológico. Este avance, logrado por investigadores de la Facultad de Medicina de Duke-NUS y de la Universidad de California en Santa Cruz, ofrece un nuevo enfoque para ajustar nuestros ritmos circadianos, los ciclos naturales de 24 horas que influyen en los patrones de sueño y vigilia y en las funciones diarias generales.
¿Qués el jet lag?
El desfase horario, también conocido como trastorno por disritmia circadiana, es un problema temporal del sueño que puede afectar a cualquier persona que atraviese rápidamente varios husos horarios.
El cuerpo tiene su propio reloj interno, denominado ritmos circadianos, que le indica cuándo debe permanecer despierto y cuándo debe dormir.
Publicados en la revista Proceedings of the National Academy of Sciences (PNAS), sus hallazgos podrían abrir el camino para nuevos enfoques para el tratamiento de los trastornos relacionados con el reloj biológico.
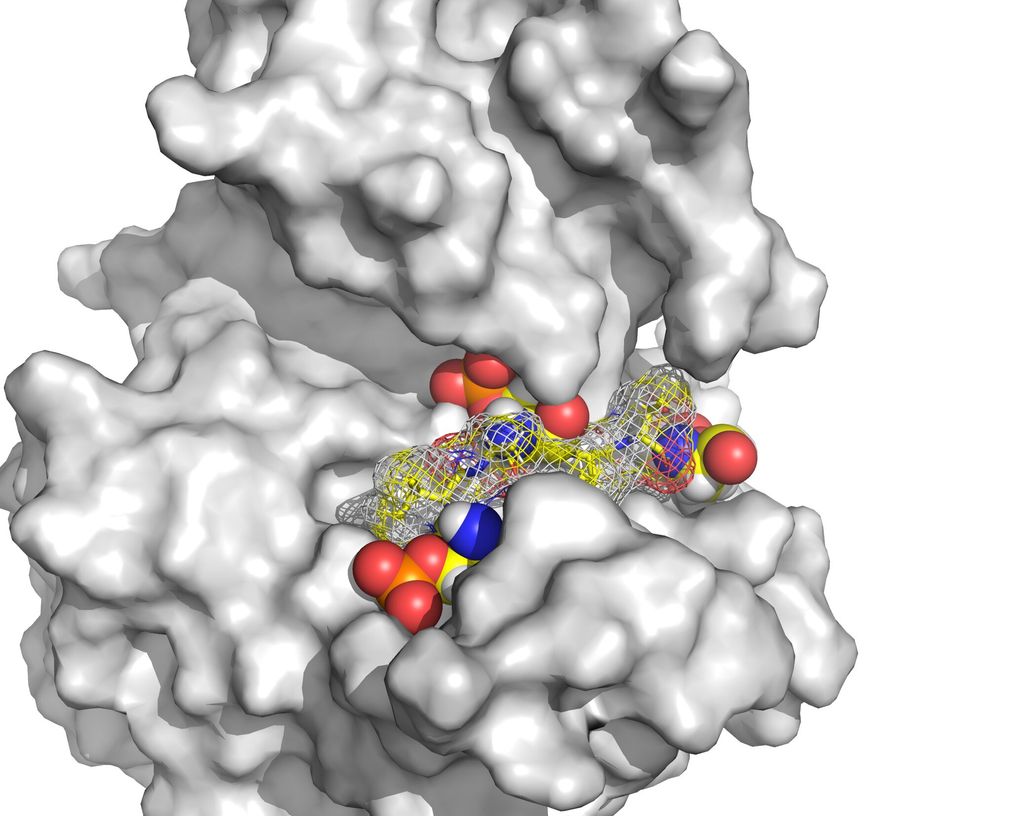
La proteína CK1Cδ
La CK1δ regula los ritmos circadianos al marcar otras proteínas que intervienen en nuestro reloj biológico para ajustar con precisión la sincronización de estos ritmos. Además de modificar otras proteínas, la propia CK1δ puede marcarse, alterando así su propia capacidad para regular las proteínas implicadas en el funcionamiento del reloj interno del organismo .
Investigaciones anteriores identificaron dos versiones distintas de CK1δ, conocidas como isoformas δ1 y δ2, que varían en tan solo 16 bloques de construcción o aminoácidos justo al final de la proteína, en una parte llamada cola C-terminal. Sin embargo, estas pequeñas diferencias afectan significativamente la función de CK1δ. Si bien se sabía que cuando se etiquetan estas proteínas, su capacidad para regular el reloj corporal disminuye, nadie sabía exactamente cómo sucedía esto.
Utilizando técnicas avanzadas de espectroscopía y espectrometría para acercarse a las colas, los investigadores descubrieron que la forma en que se etiquetan las proteínas está determinada por sus distintas secuencias de cola.
La investigadora del Instituto Médico Howard Hughes, profesora Carrie Partch del Departamento de Química y Bioquímica de la Universidad de California en Santa Cruz y autora correspondiente del estudio, explicó:
"Nuestros hallazgos señalan tres sitios específicos en la cola de CK1δ donde los grupos fosfato pueden unirse, y estos sitios son cruciales para controlar la actividad de la proteína. Cuando estos puntos se marcan con un grupo fosfato, CK1δ se vuelve menos activa, lo que significa que no influye en nuestros ritmos circadianos de manera tan efectiva. Mediante el uso de análisis de alta resolución, pudimos identificar los sitios exactos involucrados, y eso es realmente emocionante".
El profesor David Virshup, director del Programa de Biología del Cáncer y de Células Madre de Duke-NUS y coautor del estudio, quien estudió esta proteína por primera vez hace más de 30 años mientras investigaba su papel en la división celular, dijo: "Con la tecnología que tenemos disponible ahora, finalmente pudimos llegar al fondo de una pregunta que ha quedado sin respuesta durante más de 25 años.
"Hemos descubierto que la cola de δ1 interactúa más extensamente con la parte principal de la proteína, lo que lleva a una mayor autoinhibición en comparación con δ2. Esto significa que δ1 está más estrechamente regulada por su cola que δ2. Cuando estos sitios se mutan o se eliminan, δ1 se vuelve más activa, lo que conduce a cambios en los ritmos circadianos. En cambio, δ2 no tiene el mismo efecto regulador desde su región de la cola".
Este descubrimiento pone de relieve cómo una pequeña parte de la CK1δ puede influir en gran medida en su actividad general. Esta autorregulación es vital para mantener equilibrada la actividad de la CK1δ, lo que, a su vez, ayuda a regular nuestros ritmos circadianos.
El estudio también abordó las implicaciones más amplias de estos hallazgos. La CK1δ desempeña un papel en varios procesos importantes más allá de los ritmos circadianos, incluida la división celular, el desarrollo del cáncer y ciertas enfermedades neurodegenerativas. Al comprender mejor cómo se regula la actividad de la CK1δ, los científicos podrían abrir nuevas vías para tratar no solo los trastornos del ritmo circadiano, sino también una variedad de afecciones.
El profesor Patrick Tan, vicedecano sénior de investigación en Duke-NUS, añadió: "Regular nuestro reloj interno va más allá de curar el jet lag: se trata de mejorar la calidad del sueño, el metabolismo y la salud en general. Este importante descubrimiento podría abrir nuevas puertas para tratamientos que podrían transformar la forma en que gestionamos estos aspectos esenciales de nuestra vida diaria".
Los investigadores planean investigar más a fondo cómo los factores del mundo real, como la dieta y los cambios ambientales, afectan los sitios de marcado de CK1δ. Esto podría brindar información sobre cómo estos factores afectan los ritmos circadianos y podría conducir a soluciones prácticas para gestionar las alteraciones.
Referencia
Rachel L. Harold et al, Isoform-specific C-terminal phosphorylation drives autoinhibition of Casein kinase 1, Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2415567121








